ÁREA: CIENCIAS NATURALES - QUÍMICA
GRADO: OCTAVO
DOCENTE: ARMANDO TOVAR CONTRERAS
AÑO LECTIVO 2017
I PERIODO
Estimado(a) estudiante reciba un afectuoso saludo de bienvenida al nuevo año lectivo.
El presente blog lo diseño con el objeto de facilitar la interacción estudiante-docente, para hacer llegar a usted de una manera clara y sencilla los conceptos correspondientes en cada temática, a la vez que propondré una serie de situaciones que le permita a usted desarrollarlas colocando en práctica los conceptos aprendidos.
Ejes temáticos Química I periodo
GRADO: OCTAVO
DOCENTE: ARMANDO TOVAR CONTRERAS
AÑO LECTIVO 2017
I PERIODO
Estimado(a) estudiante reciba un afectuoso saludo de bienvenida al nuevo año lectivo.
El presente blog lo diseño con el objeto de facilitar la interacción estudiante-docente, para hacer llegar a usted de una manera clara y sencilla los conceptos correspondientes en cada temática, a la vez que propondré una serie de situaciones que le permita a usted desarrollarlas colocando en práctica los conceptos aprendidos.
Ejes temáticos Química I periodo
Enlaces quimicos
- Electrones de valencia
- Electronegatividad
- Clase de enlaces
- Enlace ionico
- Enlace covalente y coordinado
- Enlace metalico
Las reacciones químicas
- Clase de reacciones químicas
- Balance de ecuaciones químicas sencillas
- Interpretación de ecuaciones químicas
ACTIVIDAD # 1: Resolver de acuerdo al vídeo
- Cual es la diferencia entre: ion, cation y anión?
- Escriba 3 características de los compuestos ionicos
- Que son puentes de Hidrógeno?
- Cual es la diferencia entre maleabilidad y ductilidad?
- A que se atribuye el hecho de que el hielo sea menos denso que el agua liquida?

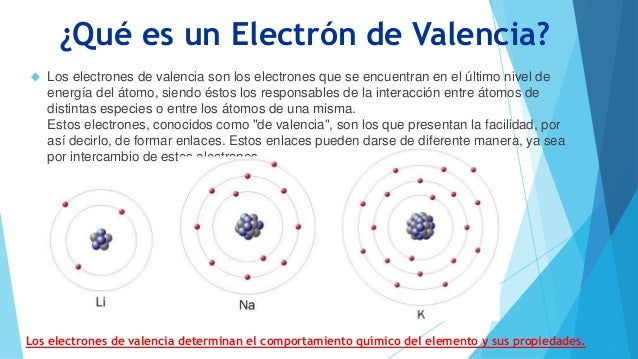
En nuestro ejemplo:Los tres atomos, Li, Na y K tiene cada uno un electron de valencia.
En la tabla periodica los elementos representativos el grupo a que pertenecen es igual al numero de electrones de valencia . asi
Grupo IA o 1 = 1 electrón de valencia
Grupo IIA o 2 = 2 electrones de valencia
Grupo IIIA o 13 = 3 electrones de valencia
Grupo IvA o 14 = 4 electrones de valencia
Grupo VA o 15 = 5 electrones de valencia
Grupo VIA o 16 = 6 electrones de valencia
Grupo VIIA o 17 = 7 electrones de valencia
Grupo VIIIA o 18 = 8 electrones de valencia
ACTIVIDAD # 2: Hallar los electrones de valencia para los siguientes átomos
a)
I b) S
c) Al d) P e) O
f) Ba g) C
h) Ca i) Br
j) Si
ELECTRONEGATIVIDAD


ACTIVIDAD #: 3
Seleccione entre las siguiente parejas de átomos
a)
Mayor electronegatividad Cu y Ba
b)
Menor electronegatividad Pd
y Sb
c)
Menor electronegatividad S y
Te
d)
Mayor electronegatividad MN
y Ca
e)
Menor electronegatividad; Pt y Mg
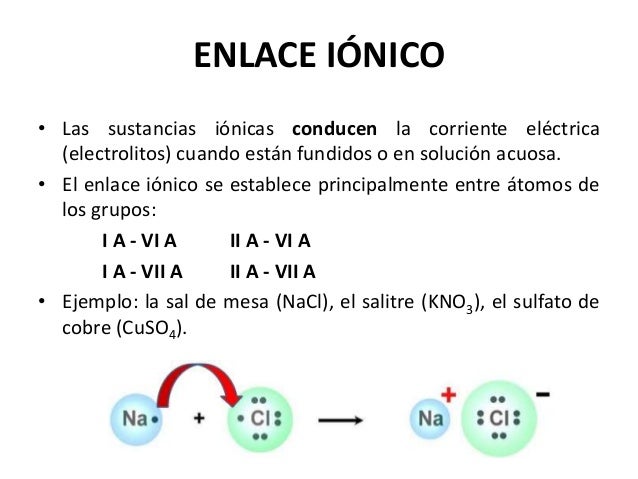
COMO FORMAR EL ENLACE IONICO
Analicemos
los dos ejemplos anteriores como se han formado los enlaces iónicos.
- Inicialmente escribimos los simbolos de los atomos como estrructura de Lewis, escribiendo sobre sus simbolos los electrones de valencia, debe ir primero el simbolo del metal.
- Luego realizo el equilibrio de electrones, utilizando los atomos necesarios para ello. En el ejemplo # 1 el Bario puede ceder 2 electrones, justo los que necesita el oxigeno para completar los 8 electrones de valencia, por lo tanto solo necesito un solo atomo de Ba para el equilibrio.
- Finalmente escribo el enlace de la siguiente manera: primero el simbolo del metal y en la parte superior derecha el numero precedido del signo mas que indique el numero de electrones que cedio cada atomo de metal utilizado, en el ejemplo # 1 solo utilice un atomo de Bario y cedio 2 electrones por eso su carga es +2
- Enseguida escribo el símbolo del no metal entre corchetes, rodeado de 8 electrones, y en la parte superior derecha escribo con signo negativo el numero que indica la cantidad de electrones que recibio cada atomo que utilice de no metal. En el ejemplo # 1 solo utilice un oxigeno que gano 2 electrones por eso -2
En el ejemplo # 2 la formula que me dan me dice que debo utilizar, 2 atomos de cloro y 1 de magnesio, los cuales los represento con estructura de Lewis igual que en el ejemplo # 1 aplicando el mismo procedimiento.
ACTIVIDAD # 4: Represente por estructura de Lewis los siguientes enlaces ionicos
a)
BaI2 b) Na2S c)
CaO d) KBr e) MgBr2
EL ENLACE IONICO Y EL VALOR DE ELECTRONEGATIVIDAD
Un enlace se considera ionico si la diferencia de electronegatividades entre sus átomos es 1.7 o más.

EJEMPLO: Diga y justifique si el enlace MgS es ionico
Hallo las electronegatividades de los átomos involucrados y realizo la diferencia entre ellos que debe ser 1.7 o más
Mg = 1.2 S = 2.4 2.4 - 1.2 = 1.2 no es ionico
EJEMPLO: Es ionico el enlace Na2O ?
Na = 1.0 O = 3.5 3.5 - 1.0 = 2.5 si es ionico
ACTIVIDAD # 5: diga si cada uno de los siguientes enlaces es ionico y justifique su respuesta
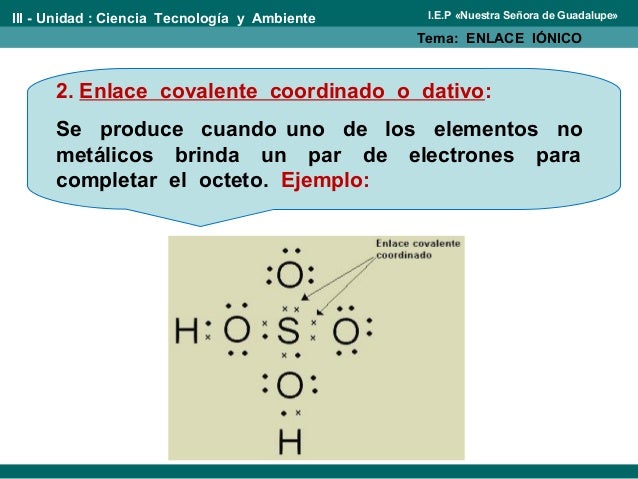
EJEMPLOS
1.
2.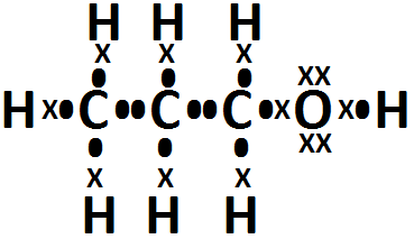
3.
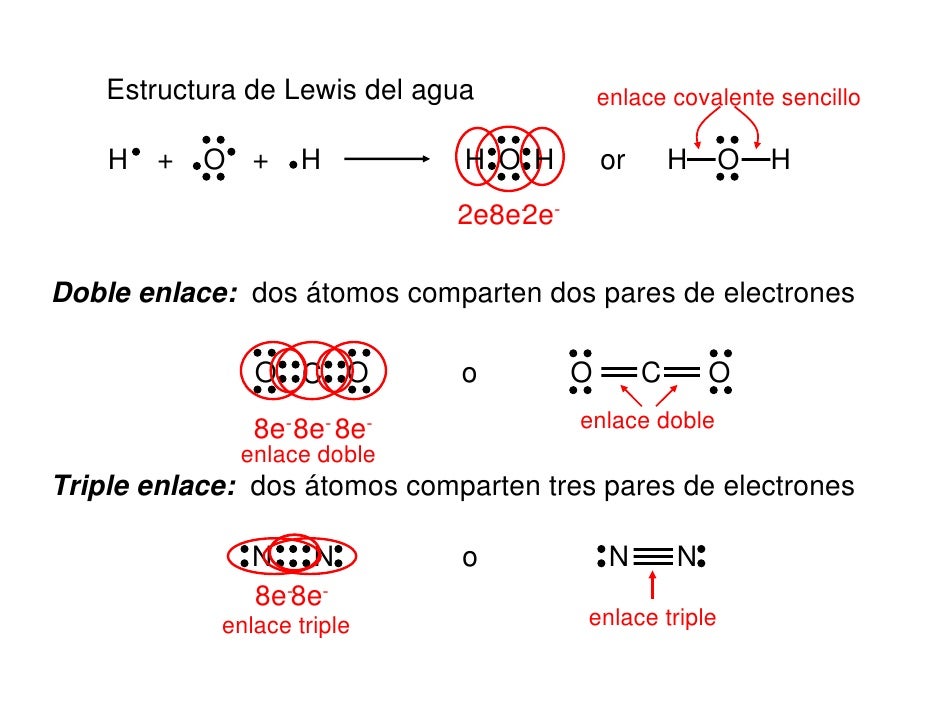
ENLACES COVALENTES MÚLTIPLES
Dependiendo del numero de pares de electrones que se compartan los enlaces covalentes pueden ser.simples, dobles o triples

ACTIVIDAD # 5 PRACTICA DE LABORATORIO # 1
1.
De acuerdo con la información de la tabla, es
válido afirmar que el compuesto con mayor carácter iónico es
ACTIVIDAD # 9 Desarrollar taller en clase acerca de temática y actividades vistas en el periodo, el estudiante puede utilizar como único recurso de consulta su cuaderno de apuntes.
ACTIVIDAD # 10: Evaluación final de periodo, taller con preguntas de opción múltiple con única respuesta con las temáticas vistas durante el periodo.
EL ENLACE IONICO Y EL VALOR DE ELECTRONEGATIVIDAD
Un enlace se considera ionico si la diferencia de electronegatividades entre sus átomos es 1.7 o más.

EJEMPLO: Diga y justifique si el enlace MgS es ionico
Hallo las electronegatividades de los átomos involucrados y realizo la diferencia entre ellos que debe ser 1.7 o más
Mg = 1.2 S = 2.4 2.4 - 1.2 = 1.2 no es ionico
EJEMPLO: Es ionico el enlace Na2O ?
Na = 1.0 O = 3.5 3.5 - 1.0 = 2.5 si es ionico
ACTIVIDAD # 5: diga si cada uno de los siguientes enlaces es ionico y justifique su respuesta
a)
K3P b) CaSe c) AlCl3 d) BaCl2 e) NaCl
FORMULA DE UN COMPUESTO IONICO
Para escribir la formula de un compuesto bonico se procede de la siguiente manera:
1. Escribo los símbolos de los elementos, empezando por el metal
2. Coloco en la parte superior del símbolo de cada elemento la carga que Cruzo puede tener según el grupo(# de oxidación).
3. Cruzo estos números sin carga y simplifico si se puede. así
actividad en clase: escriba las formulas para los siguientes compuestos ionicos
a) Ca y S b) K y I c) Mg y Cl d) Na y O e) Ba y Cl f) K y Br g) Ca y O
ENLACE COVALENTE
FORMULA DE UN COMPUESTO IONICO
Para escribir la formula de un compuesto bonico se procede de la siguiente manera:
1. Escribo los símbolos de los elementos, empezando por el metal
2. Coloco en la parte superior del símbolo de cada elemento la carga que Cruzo puede tener según el grupo(# de oxidación).
3. Cruzo estos números sin carga y simplifico si se puede. así
actividad en clase: escriba las formulas para los siguientes compuestos ionicos
a) Ca y S b) K y I c) Mg y Cl d) Na y O e) Ba y Cl f) K y Br g) Ca y O
ENLACE COVALENTE
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable, compartiendo electrones del último nivel (excepto el Hidrógeno que alcanza la estabilidad cuando tiene 2 electrones).

EJEMPLOS
1.
2.
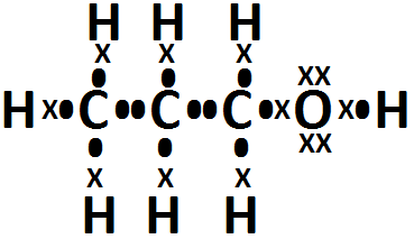
3.
ENLACES COVALENTES MÚLTIPLES
Dependiendo del numero de pares de electrones que se compartan los enlaces covalentes pueden ser.simples, dobles o triples


ACTIVIDAD # 5 PRACTICA DE LABORATORIO # 1
LEY DE LA CONSERVACIÓN DE LA MATERIA
OBJETIVO
Comprobar de forma experimental, haciendo uso de la balanza, la ley de la conservación de la materia.
INTRODUCCIÓN
Esta importante ley fue enunciada por el químico francés Antonio Lavoisier haciendo uso de la balanza. Con su experimento echó por tierra la Teoría del Flogisto.
En el estudio de los cambios de peso en las reacciones químicas, es de importancia fundamental conocer si la masa total presente es la misma antes y después de la reacción. Para conocer si la masa se conserva, se deben pesar los reaccionantes y, una vez terminada la reacción, pesar los productos. No sobra decir que, para que este experimento sea valido, se deben pesar todos los reaccionantes y todos los productos.
MATERIALES
- Balanza
- Matraz o Erlenmeyer de 100 ml
- Botella de gaseosa de 100 ml aprox.
- Agua
- Banda Elástica de caucho
- Embudo
- Dos (2) alkaseltzer
- globo sin inflar
- Paño absorvente
PROCEDIMIENTO
- Pese la botella, el globo y la banda de caucho
- Mida 100 ml de agua en un matraz
- Con ayuda del embudo agregue los 100 ml de agua a la botella, y pese nuevamente
- Pese las 2 alkaseltzer solos,
- Luego triturelos sobre una hoja de papel cerrada, introduzca el polvo hasta el fondo en el globo, con cuidado de no perder parte de sus componentes
- Coloque con cuidado la boca del globo en la botella y asegurelo muy bien con la banda de caucho.
- Pese el sistema completo: botella, agua, globo, banda, alkaseltzer triturado.
- Vierta a la botella el polvo contenido en el globo
- Observe lo sucedido
- Registre el peso después de la reacción
RESULTADOS
- Peso total del sistema antes de mezclar
- Peso total del sistema después de mezclar
- La reacción observada corresponde a un cambio químico o físico? ¿Porque?
- Si la densidad de un liquido se calcula dividiendo la masa sobre el volumen, cual es la densidad del agua?
- Cual es la densidad del alkaseltzer disuelto?
- De acuerdo con los resultados obtenidos, ¿ Se pudo comprobar la ley de la conservación de la materia? ¿Porque?
- Escriba la ecuación representativa de la reacción observada.
ACTIVIDAD # 6 Resolver el siguiente taller justificando su respuesta
Conteste las preguntas 1 y 2 de acuerdo a la información de la siguiente tabla:
Conteste las preguntas 1 y 2 de acuerdo a la información de la siguiente tabla:
La tabla presenta la electronegatividad de 4 elementos X, J, Y y
Elemento
|
X
|
J
|
Y
|
L
|
Electronegatividad
|
4.0
|
1.5
|
0.9
|
1.6
|
A. LX
B. JL
C. YJ
D. YX
2.
De acuerdo con la información de la tabla, es
válido afirmar que el compuesto de mayor carácter covalente es
A. LY
B. JL
C. YX
D. YJ
A. H-O
B. H-Na
C. H-S
D. H-Cl
4.
Los tipos de enlace que pueden darse entre
dos átomos pueden ser:
A. Iónico y
covalente.
B. Iónico,
covalente y metálico.
C. Iónico,
covalente, metálico y por fuerzas de Van der Waals.
D. Iónico, covalente,
metálico, por fuerzas de Van der Waals y por puente de hidrógeno.
5. ¿En cual de los compuestos siguientes tiene
un enlace fundamentalmente iónico?
A. H 2
O
B. C Cl 4
C. BeH 2
D. NaI
6.
Indicar la afirmación correcta basándose en
la tabla de electronegatividad de los elementos, en cuanto al tipo de enlace
que se formará entre los elementos que se indican:
A. El Ca y el
O forman un enlace covalente polar
B. El H y el
Cl forman un enlace iónico
C. El K y el
F forman un enlace iónico
D. El H y en
Br forman un enlace covalente apolar
7.
Indique la afirmación correcta, basándose en
la electronegatividad de los elementos señalados: “Se formará entre ...
A. El Ca y el
O un enlace parcialmente covalente o covalente polar
B. El H y el
Cl un enlace iónico
C. El K y el
F un enlace iónico
D. El H y el
Br un enlace covalente puro o apolar
8.
De los compuestos que a continuación se
indican, es preferentemente iónico el:
A.
C Cl 4
B.
BeH 2
C.
KBr
D. H 2
O
9.
Para que entre dos átomos exista un enlace
iónico:
A.
Ambos deben tener una electronegatividad
semejante.
B.
Uno debe tener una afinidad electrónica alta
y otro un potencial de ionización baja.
C.
Uno de ellos debe tener una electroafinidad
alta y el otro, debe tener una energía de ionización alta.
D.
Solamente puede darse entre un halogeno y un
alcalino.
10.
El FLUOR (Z =19) y el SODIO (Z = 11) se unen
dando un compuesto del cual podemos decir que se forma:
A.
Por transferencia de un electrón de cada
átomo de sodio a cada átomo de flúor.
B.
Por transferencia de dos electrones de cada
átomo de sodio a cada átomo de flúor
C.
Por compartición de un par de electrones
procedentes uno del átomo de sodio y otro del átomo de flúor.
D.
Por compartición de dos electrones
procedentes ambos del átomo de sodio.
11.
Indica cual de los siguientes compuestos es iónico:
A.
HCl
B.
NaBr
C.
CS 2
D.
N 2
O
12. Entre los siguientes compuestos, señala aquel
cuyos enlaces presenten un mayor carácter iónico:
A.
RbCl
B.
NaI
C.
MgO
D.
CsF
13. Señala cual de los siguientes compuestos no
es iónico:
A.
Ag 2 SO
4
B.
CuCl 2
C. HCl
D. Na 2
S
REACCIONES QUÍMICAS
Una reacción química es un proceso por el cual una o más sustancias, llamadas reactivos, se transforman en otra u otras sustancias con propiedades diferentes, llamadas productos. En una reacción química, los enlaces entre los átomos que forman los reactivos se rompen.
Una reacción química se representa por medio de una ecuación química. La cual consta de las siguientes partes

ACTIVIDAD # 7: EN un máximo de dos paginas define las siguientes reacciones y escribe tres ejemplo de cada una.
.
BALANCE e interpretacion DE ECUACIONES QUÍMICAS

Esta ecuación después de balancearla se interpreta de la siguiente manera:
1 mol de N2 reacciona con 3 moles de H2 para producir 2 moles de NH3
REACCIONES QUÍMICAS
Una reacción química es un proceso por el cual una o más sustancias, llamadas reactivos, se transforman en otra u otras sustancias con propiedades diferentes, llamadas productos. En una reacción química, los enlaces entre los átomos que forman los reactivos se rompen.
Una reacción química se representa por medio de una ecuación química. La cual consta de las siguientes partes

ACTIVIDAD # 7: EN un máximo de dos paginas define las siguientes reacciones y escribe tres ejemplo de cada una.
- Síntesis
- Descomposición o análisis
- Desplazamiento o sustitución
- Doble sustitución o intercambio
BALANCE DE ECUACIONES QUÍMICAS
.
BALANCE e interpretacion DE ECUACIONES QUÍMICAS

Esta ecuación después de balancearla se interpreta de la siguiente manera:
1 mol de N2 reacciona con 3 moles de H2 para producir 2 moles de NH3
Pasos que son necesarios para escribir una reacción ajustada:
1) Se determina cuales son los reactivos y los productos.
2) Se escribe una ecuación no ajustada usando las fórmulas de los reactivos y de los productos.
3) Se ajusta la reacción determinando los coeficientes que nos dan números iguales de cada tipo de átomo en cada lado de la flecha de reacción, generalmente números enteros
2 moles de HCl reaccionan con 1 mol de Ca(OH)2 para producir 1 mol de CaCl2 y 1 mol de H2O
De esta manera la ecuación ya esta ajustada y su lectura o interpretación es:
2 moles de CH3OH reaccionan con 1 mol de PCl5 para producir 2 moles de CH3Cl mas 1 mol de PCl3 y 1 mol de H2O
ACTIVIDAD # 9 Desarrollar taller en clase acerca de temática y actividades vistas en el periodo, el estudiante puede utilizar como único recurso de consulta su cuaderno de apuntes.
ACTIVIDAD # 10: Evaluación final de periodo, taller con preguntas de opción múltiple con única respuesta con las temáticas vistas durante el periodo.












